


BL-AC40TS 生物探针 DNA折纸、扫描、液相探针
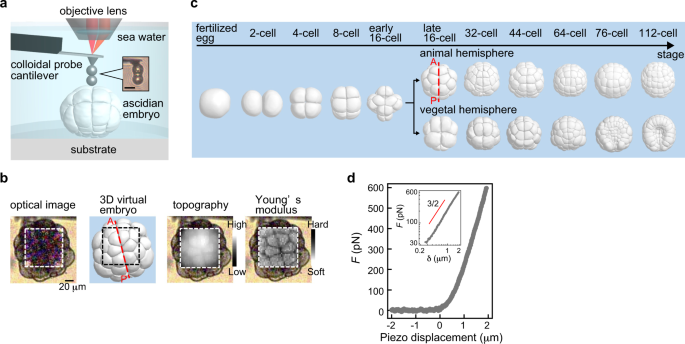
在空气中约 110 kHz 和水中约 25 kHz 的高共振,而其小弹簧常数约为 0.1 N/m。高共振悬臂值得快速扫描,以缩短数据采集时间,并在放大样品表面的目标区域时进行平滑快速的操作。 尖端半径为 10 nm(典型值)的锐化硅尖端 氮化硅悬臂,最大限度地减少了其自发荧光,不会成为荧光观察的障碍。 每个悬臂芯片都被隔离在外壳中。外壳一打开,芯片就可以连接到 AFM 仪器上。 “BioLever mini”有一个两层结构的硅探针(见右图)。探针支架上的探针看起来是四面体,并且通过氧化过程进一步锐化了顶点。它显示出比传统金字塔形尖端更高的纵横比。 由于尖端锋利,建议使用“BioLever mini”在生物分子、DNA 链等研究中将图像分辨率提高一个档次。 长尖端的工作原理是对生物细胞等相对较厚的样品进行 AFM 成像。 生物样品,如散布在云母基底上的 DNA 链,在基底上的密度不会均匀。那么,在观察这样的样品时,会从大面积到小面积对样品进行多次扫描。一系列的观察步骤,会不断重复,直到在一定的放大倍数下清楚地揭示出一个兴趣点。然而,以前的大尺寸悬臂由于在水中的阻尼大,无法在水中快速扫描。众多运营商所渴望的,是缩短搜索时间,以确认扫描区域是否包含目标DNA。在观察系列的早期阶段,快速成像比高分辨率成像更有利。快速扫描需要像“BioLever mini”这样的在水中具有高共振的悬臂。 带有“Bio-Lever mini”的蛋白质拉伸曲线(数据由利兹大学 M. Kawakami 博士提供。英国。) 在使用'BioLever mini'时,建议在液体中进行AFM系统控制参数的调整,如激光传感器光斑的位置调整、反馈伺服增益等。因为“Bio-Lever mini”是专为在液体中使用而设计的。 “BioLever mini”(左图)在观察染色生物样品的荧光时比传统氮化硅悬臂梁(右图)发出的自发荧光更少。 “BioLever mini”对荧光光学显微镜的干扰比传统的软悬臂探针少。 BL-AC40TS-C2 纳米力学量测应用: 在 Cypher S AFM (Asylum Research) 上使用由 0.6 N/m 标称刚度和 0.6 μm 直径 SiO 2 的氮化硅悬臂组成的圆尖探针对水合状态的散装丝纳米纤丝凝胶进行纳米压痕连接在探针末端的珠子 (Novascan Technologies)。实验前,悬臂在空气中的灵敏度是通过压入硬表面(载玻片)来校准的,然后通过捕获和拟合悬臂在空气中的热谱来校准弹簧常数。然后将悬臂浸入水中,通过热法再次获得其在水中的灵敏度。在每个位置进行 20 × 20 μm 面积上的 6 × 6 压痕网格,每个样品至少压入六个不同的位置。数据采集的速率为 1.0 μm/s,撤回距离为 1.0 μm,偏转触发器为 100 nm。使用 Hertz、JKR 和 Oliver-Pharr 模型分析力-压痕曲线,假设泊松比为 0.33。 定制的原子力显微镜46用于绘制海鞘胚胎样品的相对高度和表观杨氏模量E。原子力显微镜安装在直立式光学显微镜(Eclipse FN1,尼康)上,具有用于光学杠杆系统的液浸物镜(plan fluor,×10,Nikon),如先前报道的46. 我们使用了标称弹簧常数 <0.1 N/m 的矩形悬臂(Biolever-mini,BL-AC40TS-C2,Olympus)。在实验之前,使用商用原子力显微镜(MFP-3D,Asylum Research)中内置的热波动程序在液体环境中确定悬臂的弹簧常数。为了实现明确定义的接触几何形状并防止悬臂梁和样品表面之间的接触,两个半径R为约 5 μm (Funakoshi) 从 AFM 尖端与环氧树脂胶 (Nichiban) 串联排列。 AFM力图测量是在18°C的胚胎上部区域的一部分中进行的,使用LabVIEW软件(National Instruments)控制的压电扫描仪(E-761,Physik Instruments),其中胚胎样品弱粘附在培养皿,从而高度防止异常细胞分裂。然而,弱附着力偶尔会引起意想不到的小波动。因此,AFM 的映射位置被手动改变,以根据样本波动追踪发育过程中胚胎的大致相同区域。扫描范围约为 72 × 72 μm,间距为 3 μm。单个映射图像的采集时间约为 3 分钟,扫描速度较慢,这减少了胚胎样本的意外移动。最大加载力设置为 0.6 nN。21 . BL-AC40TS-C2 Nanomechanical property of C22 phage( C22 phage 纳米压痕) AFM 成像测量是用 NanoWizard 3 BioScience AFM (JPK, Bruker) 进行的。在液体条件下以非接触模式(交流模式)收集图像。在液体条件下收集的噬菌体样品数据包括噬菌体结构17 的形状、形态和尺寸。在非接触模式下,当悬臂在样品表面(X 轴和 Y 轴)上扫描时,末端带有纳米尺寸尖端的 AFM 悬臂会发生振荡。响应振幅被转换为样品的高度(Z 轴)。 BL-AC40TS-C2 LLO(李斯特菌溶血素)孔成像 BioLever mini 的突出特点
1. 液体中 AFM 数据采集的时间节省
2. 液体中的高分辨率测量
3. 液体中力曲线测量灵敏度高
4. 在与荧光光学显微镜结合的 AFM 系统中使用
5. 预分离芯片
关于 BioLever mini 的更多信息



对于水中的力曲线测量,小面积杠杆受到的水阻尼较小,因此它可以快速响应生物分子的形状变化,并且弛豫时间短。note

使用 BL-AC40TS (Olympus) 探针在 Cypher S AFM (Asylum Research) 上通过快速力映射模式对水中的肽组件和丝纳米纤维进行纳米力学测量。将 50 μL 稀释样品的等分试样滴在新切割的云母表面 ( φ = 10 毫米,Ted Pella)并在成像前在潮湿的室内静置 30 分钟。在将悬臂浸入水中之前,首先使用 Asylum Research 软件的内置 GetReal 函数校准悬臂弹簧常数和空气中的灵敏度,然后通过捕获和拟合悬臂在水中的热谱来计算悬臂在水中的灵敏度。水。所有力图均以 0.5 Hz 的扫描速率和 256 × 256 像素的分辨率获得。每个像素的杨氏模量是通过使用 Igor Pro (WaveMetrics Inc.) 用 JKR 模型拟合力-压痕曲线来获得的。对于每个模量图,
BL-AC40TS-C2 DNA 折纸
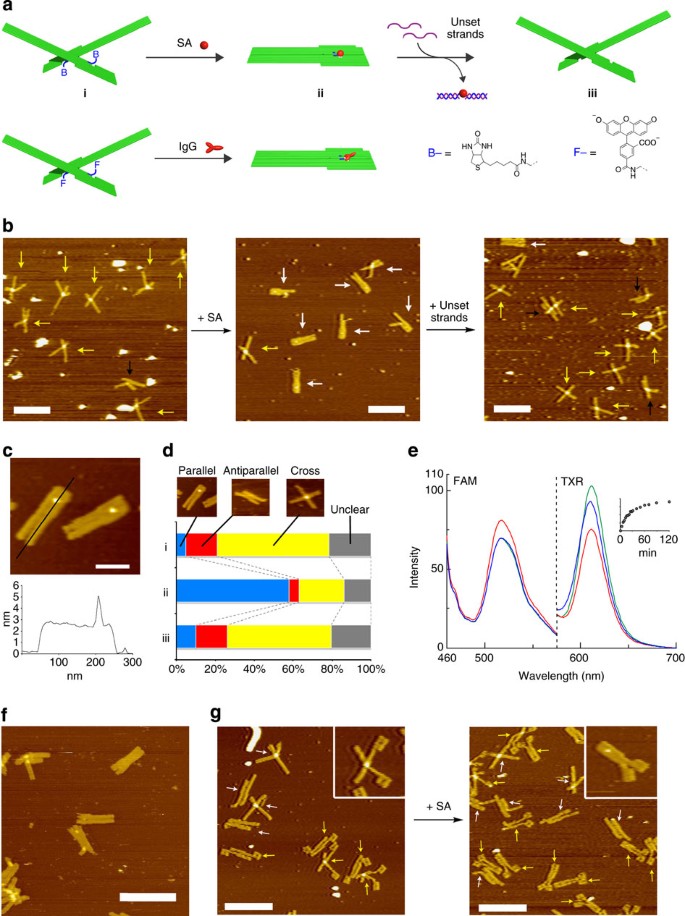
将含有 DNA 折纸装置和靶标 (3 μl) 的混合物沉积在新鲜切割的云母上;添加额外的 1×TAE/Mg 2+缓冲液 (200 μl);成像是在流体 DFM 扫描模式下使用 BL-AC40TS 尖端(奥林巴斯)进行的。典型的缩小图像显示在补充图 S11-S18 中. 图像中的 DNA 折纸装置被视为十字形,当两端明显分开并且支点周围的杠杆明显没有平行放置时。当至少有一个末端被清楚地识别为头对头(靠近凹面的杠杆末端)或尾对尾(杠杆的另一端)时,它们被算作平行形式接触,或当至少有一个末端明显观察到头对尾接触时变成反平行形式。
BL-AC40TS-C2 测量胚胎细胞的机械性能
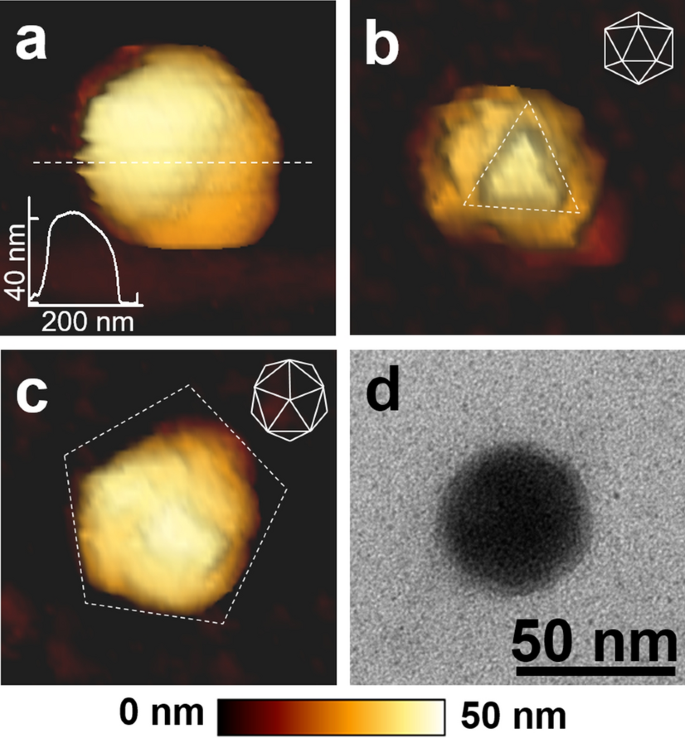
除了溶液中的成像能力外,还可以通过在力谱模式下应用基于 AFM 的纳米压痕技术,从它们的刚度来评估病毒颗粒的纳米机械特性。使用 BioLever mini BL-AC40TS-C2 (Olympus) 悬臂,通过热调谐确定弹簧常数为 0.02 至 0.14 N/m。C22噬菌体粒子的中心区域通过在粒子图像完全收集后选择粒子的中心来精确定位。在单个足状病毒颗粒的中心区域施加约 1 nN 的力(图 1a,左)。力-距离(FD)曲线(图 1a,右)在 C22 噬菌体颗粒(蓝色曲线)上与云母表面上的 FD 曲线(红色曲线)一起收集。蓝色曲线说明了粒子和悬臂的压痕,而红色曲线说明了悬臂的压痕。因此,两条曲线之间的距离差异表明 C22 噬菌体颗粒上的压痕。从 FD 曲线的线性区域计算的斜率被视为刚度或弹簧常数值(每距离的力,单位为 N/m)。从颗粒上的压痕中提取的刚度和从云母表面上的压痕中提取的刚度是基于 C22 噬菌体颗粒的刚度在别处28 中描述的。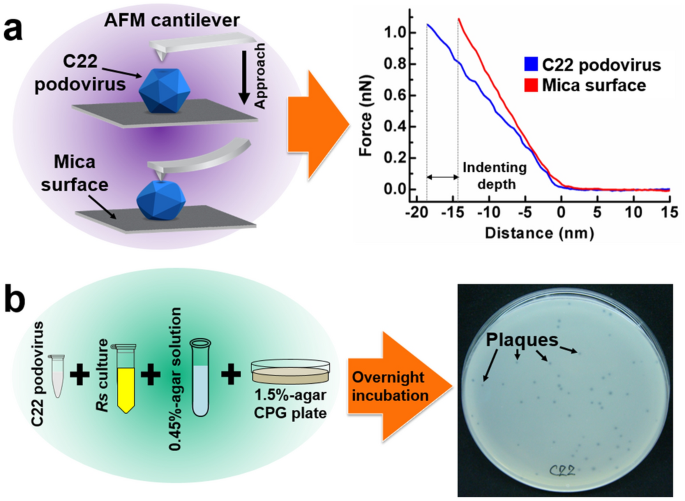
原子力显微镜 (AFM) 也可用于通过与膜插入相关的低聚物高度的降低来区分前孔和孔。AFM 成像显示两个 pH 值之间的孔半径没有差异。然而,它清楚地显示了在任一 pH 值下功能孔高度分布的异质性,表明 LLO 孔具有高可塑性,并且膜插入是 LLO 低聚物的渐进过程。我们进一步表明,观察到的孔的 pH 依赖性电导受 H311 调节,H311 是 LLO 独有的残留物。突变分析表明,H311 调节 LLO 单体的构象稳定性以及孔形成的动力学,并且该 His 侧链的缺失导致与 pH 无关的电导曲线。最后,延时 AFM 成像显示一些孔和弧融合成形状不规则且尺寸比预期大得多的孔,这可能与感染期间李斯特菌的细胞运输有关。突变分析表明,H311 调节 LLO 单体的构象稳定性以及孔形成的动力学,并且该 His 侧链的缺失导致与 pH 无关的电导曲线。最后,延时 AFM 成像显示一些孔和弧融合成形状不规则且尺寸比预期大得多的孔,这可能与感染期间李斯特菌的细胞运输有关。突变分析表明,H311 调节 LLO 单体的构象稳定性以及孔形成的动力学,并且该 His 侧链的缺失导致与 pH 无关的电导曲线。最后,延时 AFM 成像显示一些孔和弧融合成形状不规则且尺寸比预期大得多的孔,这可能与感染期间李斯特菌的细胞运输有关。
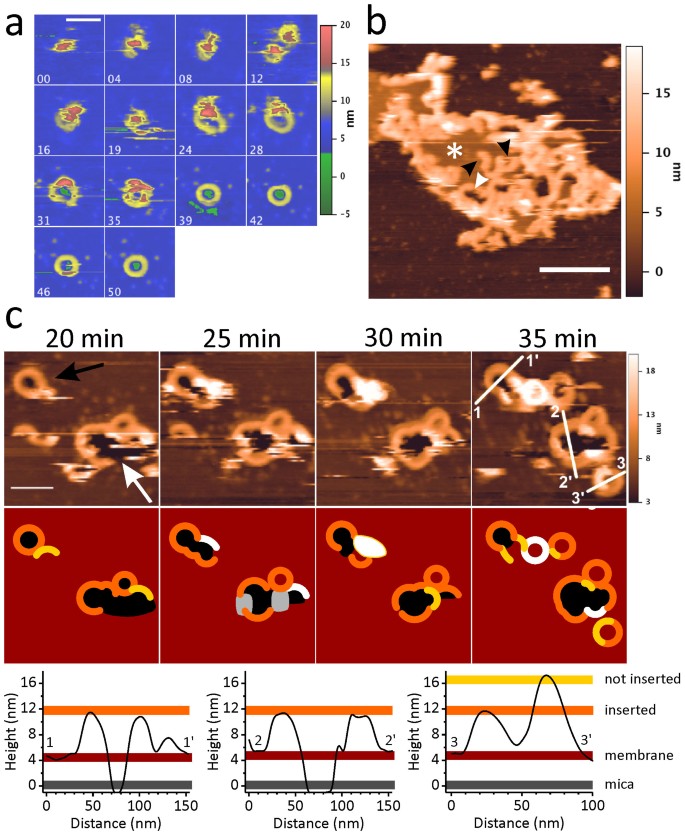
通过 AFM 成像的 LLO 孔形成动力学。
(a) 野生型 LLO 在 SLB 上在 pH 5.5 上形成孔的时间过程。每个图像左上角的数字以分钟为单位显示时间。高度刻度上的颜色代码与图 1C 中的相同; 比例尺长度对应于 100 nm。(b) 在 pH 5.5 的 SLB 上扫描野生型 LLO 寡聚体。白色星号标记脂质双层补丁。黑色箭头表示弧状结构。由彼此面对的弧形形成的大多孔结构用白色箭头标记。比例尺长度对应于 500 nm。( c )由 H311A 突变体在 pH 5.5 的 SLB 上形成的寡聚物的时间演变。上半部分:四次 AFM 扫描,以 5 分钟的时间间隔采集,显示新结构的生长和融合,具有已形成的环(黑色箭头)和大型结构的闭合,主要由连接的弧组成或轮廓化(白色箭头)。在将蛋白质注射到 SLB 后计算面板上方指示的时间。以下:上图中 AFM 扫描的草图重建,以清楚地描绘各种蛋白质聚集体的形状和高度。35 分钟后,沿着 (c) 中 AFM 图像中显示的白线的蛋白质聚集体的高度分布显示在图像下方。
